
In juli 2022 zijn namens het European LeukemiaNet (ELN) nieuwe aanbevelingen voor de diagnostiek en behandeling van acute myeloïde leukemie (AML) gepubliceerd.1 Deze aanbevelingen vervangen de eerdere editie van 2017.2 Prof.dr. Gerwin Huls (UMCG Groningen) deelt in dit artikel zijn visie op de impact van deze ELN-aanbevelingen voor de Nederlandse praktijk.
“De WHO heeft recent de nieuwe diagnostische criteria voor AML en andere myeloïde ziekten gepubliceerd. Parallel daaraan is onlangs een internationaal consensusdocument verschenen (International Consensus Classification, ICC) met criteria die afwijkend zijn van die van de WHO.3,4 De ELN-aanbevelingen gaan uit van deze ICC-criteria. Als leukemiewerkgroep van de HOVON hebben we onlangs besloten om deze nieuwe ICC-criteria te volgen bij de formulering van een herziene versie van de huidige AML-richtlijn.5”
“De belangrijkste aanpassingen van de ELN-aanbevelingen liggen op het gebied van ziekteclassificatie, risicoclassificatie en de responscriteria. De ELN-aanbevelingen zijn met name belangrijk voor de risicoclassificatie van AML. De aanpassingen van de WHO en de ICC/ELN gaan voort op de ingeslagen richting, waarbij men steeds meer afstapt van de morfologie en steeds meer leunt op de genetische en moleculaire afwijkingen van AML. Ten aanzien van de ziekteclassificatie spreekt het ELN bij meer dan 10% blasten in het bloed of beenmerg van een MDS/AML (in plaats van myelodysplastisch syndroom, MDS) en bij meer dan 20% van AML. Daarmee is hoog-risico MDS dus gevangen in de nieuwe entiteit van MDS/AML. Bij de ziekte-indeling van AML is bovendien een volgordelijkheid aangebracht.” (zie Figuur 1)
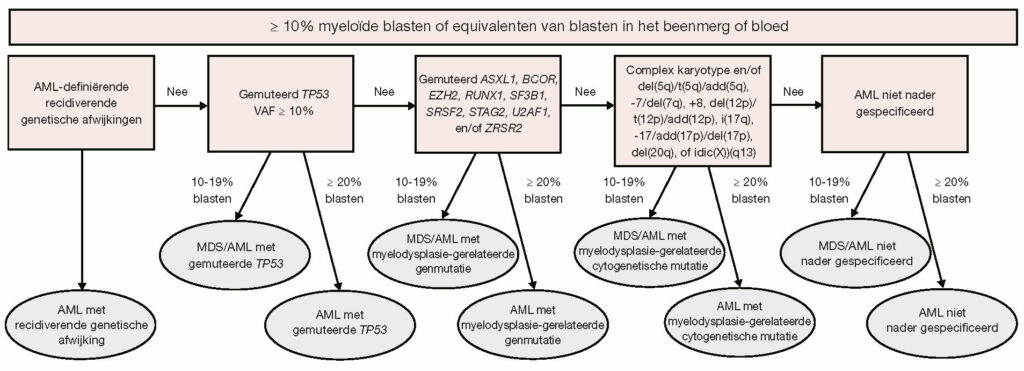
Aanpassing van de ziekte-indeling
“Volgens deze nieuwe ziekte-indeling vormen patiënten met een TP53-mutatie een aparte subgroep. Verder wordt ook bij gedefinieerde moleculaire en cytogenetische afwijkingen al boven de grens van 10% blasten gesproken van AML. In het verleden was dit alleen het geval bij mutaties van core-binding factoren, maar dit is nu uitgebreid met bijvoorbeeld de NPM1-mutaties. Bij de (tamelijk subjectieve) groep van therapiegerelateerde myeloide neoplasie en de myelodysplasie-gerelateerde veranderingen (AML-MRC) zijn de morfologische criteria losgelaten en draait het volledig om moleculaire criteria. Patiënten met AML met mutaties in ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1 en ZRSR2 worden beschouwd als classificerend voor AML met myelodysplasie-gerelateerde moleculaire afwijkingen. (zie Figuur 1) Dit is gebaseerd op een recente publicatie van Coleman Lindsley, et al.6“
Aanpassingen van de risicoclassificatie
“Ook ten aanzien van de risicoclassificatie is er een aantal aanpassingen. Zo is FLT3-ITD verlaten als criterium in de risicoclassificatie. Waar voorheen de ‘allelic burden’ van een FLT3-mutatie heel belangrijk was, is men daarvan nu helemaal afgestapt. Een belangrijke verandering is verder dat AML met myelodysplasie-gerelateerde moleculaire afwijkingen, zoals splice-factor mutaties, nu als aparte AML-subgroep deel uitmaken van de groep met een slecht risico. NPM1-mutaties worden niet altijd meer beschouwd als een gunstig risico. Patiënten met een slecht risico cytogenetische afwijking en een NPM1-mutatie worden nu beschouwd als een hoog-risico AML. Een andere belangrijke toevoeging is dat men ervan is afgestapt om bi-allelisch gemuteerde C/EBPα te beschouwen als een gunstig risico. Het type mutatie (in het ‘basic leucine zipper’ (bZIP) domein) bepaalt voortaan of het risico gunstig of ongunstig is en niet of deze in beide allelen voorkomt. Verder is er nog een aantal moleculair-cytogenetische toevoegingen gedaan aan de groep met een hoog risico. Zo gelden 3q26- en t(8;16)-translocaties als ongunstige risico’s. Ook geldt het hebben van meerdere trisomieën binnen de groep van hyperploïde genotypes niet langer als een complex karyotype.”
Aanpassingen van de responscriteria
“Ten aanzien van de responscriteria hebben we, zeker binnen HOVON, een traditie om te kijken naar meetbare restziekte (MRD). Daarbij wordt MRD beschouwd binnen de context van complete remissie (CR). Van CR is sprake bij < 5% blasten in het beenmerg met voldoende herstel van trombocyten en neutrofielen. Door het ELN-2022 is er ook ruimte om te classificeren als MRD-negatief als er sprake is van CRi of CRh. CRh is geïntroduceerd als nieuwe entiteit binnen de responscriteria en verwijst naar een ‘halve’ regeneratie. Dit houdt in dat de trombocyten ten minste > 50×109/l moeten zijn én de neutrofielen > 500×109/l (in plaats van respectievelijk > 100 en > 1000 bij een CR). Deze CRh wordt veel gebruikt in klinische studies, omdat er meer en meer myelotoxische regimes bijkomen, waarmee niet altijd een volledig herstel van de perifere bloedwaarden wordt bereikt. Indien er minder dan 5% blasten in het beenmerg worden gemeten en er nog onvoldoende herstel is van de bloedwaarden, geldt dit als een MLFS (‘morphological leukemia free state’) of een CRi, ook als de bloedwaarden 3 dagen later wel een volledig herstel zouden vertonen omdat de punctie wat te vroeg was uitgevoerd. Daarover zegt de ELN nu dat de beste bloedwaarden na de punctie meetellen ter beoordeling van de respons en dat in die zin een upgrading dus mogelijk is. Daarnaast zijn er nieuwe groepen toegevoegd zoals ‘no-response’ (in plaats van ‘stable disease’) en een ‘not evaluable for response’-groep. Deze laatste komt in de plaats van de groep met ‘death in aplasia’, waarbij geen beenmergonderzoek is uitgevoerd.”
“Ook in Nederland zullen we op basis van de nieuwe ELN-aanbevelingen risicogroepen anders moeten gaan definiëren. De aangepaste risicoclassificatie zal ertoe leiden dat bepaalde patiëntengroepen in een andere risicocategorie worden ingedeeld dan voorheen en daardoor voor een andere behandeling in aanmerking zullen komen, die hiermee verband houdt. De belangrijkste implicatie van de ELN-aanbevelingen zal zijn dat risicogroepen anders worden gedefinieerd en dat daardoor andere patiënten worden aangeboden voor een allogene stamceltransplantatie. Zo werd een NPM1-mutatie met hoog-risico cytogenetica voorheen beschouwd als gunstig risico, waarbij een patiënt in aanmerking kwam voor autologe stamceltransplantatie. Op grond van de huidige risico-indeling zullen we dat nu niet meer doen. Ook de gehele groep met myelodysplasie-gerelateerde moleculaire afwijkingen, met name met splice-factor mutaties, is nu een hoog-risicogroep geworden en gaat voortaan standaard voor allogene stamceltransplantatie, mits patiënten daar fit genoeg voor zijn. Dat zijn patiënten die voorheen vaak werden ingedeeld in andere risicogroepen.”
“De IDH-mutaties zijn door het ELN niet ingedeeld als specifieke subgroep van AML. Daarmee vallen ze dus nog gewoon onder AML, al betreft het wel een subgroep waarvoor specifieke geneesmiddelen zijn ontwikkeld. Die zijn overigens nog niet in Europa geregistreerd. De HOVON 150 is een registratiestudie waarin de impact van toevoeging van twee IDH-remmers, enasidenib en ivosidenib, wordt onderzocht als adjuvante therapie bij intensieve chemotherapie.
Op grond van de recent gepubliceerde resultaten van de AGILE-studie weten we dat toevoeging van ivosidenib aan azacitidine in de niet-fitte setting een duidelijk overlevingsvoordeel oplevert voor patiënten met een IDH1-mutatie.7 Aan de andere kant weten we ook dat de groep met een IDH1– of IDH2-mutatie het relatief goed doet op venetoclax met azacitidine. Dat geldt met name voor de IDH2-mutanten. Dus voor de IDH1-mutanten zou dat betekenen dat we eigenlijk twee behandelopties hebben (venetoclax met azacitidine of ivosidenib met azacitidine). Over de vraag waarnaar de voorkeur uitgaat, is het voordeel bij venetoclax dat niet eerst de mutatie hoeft te worden bepaald. Nadeel is echter dat de groep met IDH1-mutaties het op venetoclax minder goed doet dan de IDH2-mutantengroep. Het voordeel van ivosidenib met azacitidine is dat ivosidenib leidt tot differentiatie, waardoor patiënten geen langdurige, diepe neutropenie hebben. Dat maakt deze behandeling veel vriendelijker en minder toxisch voor de toch wat kwetsbare, oudere patiënt. Het nadeel van ivosidenib is evenwel dat er eerst een mutatie-analyse moet worden uitgevoerd zodra je de patiënt ziet. Ook kan het als voordeel worden gezien dat de meerwaarde van ivosidenib is onderzocht in een specifieke studie, die was ontworpen om deze vraag te beantwoorden. Bij venetoclax weten we dat alleen achteraf een subgroepanalyse is uitgevoerd, die laat zien dat de groep met een IDH1-mutatie baat heeft bij venetoclax. De huidige discussies binnen de HOVON-werkgroep hierover lijken in de richting te gaan van een lichte voorkeur voor ivosidenib bij deze subgroep, mits er voldoende tijd is om een mutatie-analyse uit te voeren. Verder zal de HOVON 150-studie moeten uitwijzen of IDH-remmers in combinatie met intensieve chemotherapie bij fitte patiënten in aanmerking komen voor registratie. Want wat op biologische gronden wordt verondersteld, moet wel op de juiste wijze worden bewezen.”
“Bij de herziening van de AML-richtlijn zullen we de risicogroepen anders moeten definiëren. Dat zal naar verwachting in de komende maanden gaan plaatsvinden. De richtlijn is modulair opgezet en daarom zal met name alleen de module risicoclassificatie aanpassing behoeven.”
Geschreven door drs. P.W.E. van Rijn (Ariez) onder eindredactie van prof.dr. G.A. Huls
Referenties